Внутридолевая секвестрация легкого. Клиническое наблюдение
Ворончихин В. В., врач отделения лучевой диагностики 1,
Волкова Н. В., зав. отделением лучевой диагностики 1,
Санников О. Р., врач эндоскопист, к. м.н. 2
1 БУЗ УР «Глазовская городская больница № 1 МЗ УР»
2 ФБУЗ МСЧ № 41 ФМБА России
г. Глазов
Секвестрация легких (s. pulmonary sequestration, bronchopulmonary sequestration, BPS, bronchoarterial malinosculation) — порок развития, характеризующийся двумя основными признаками: отсутствием связи пораженного участка с бронхиальной системой легкого и кровоснабжением из аномальных артерий, отходящих непосредственно от аорты или ее ветвей [1–6]; среди всех врожденных заболеваний органов дыхания распространенность данной аномалии составляет 0.15 % — 6 % [1]. Наиболее часто поражаются нижнедолевые сегменты [14], правое и левое легкое вовлекаются в патологический процесс с одинаковой частотой. Заболевание чаще встречается у мужчин, чем у женщин (3:1) [7]. Легочная секвестрация может сочетаться с другими пороками развития, такими как гипоплазия почек, открытое средостение, воронкообразная грудная клетка, легочные кисты, врожденные аномалии сердца, пищеводно-бронхиальные свищи, диафрагмальные грыжи [8].
Термин «легочная секвестрация» впервые был использован в 1946 году Pryce [1], некоторые авторы используют определение bronchoarterial malinosculation [16]. В 1777 г. Huber сообщил о двухлетнем ребенке, у которого отмечалась аномалия сосудов — сообщение грудной аорты с сосудами нижней доли правого легкого [1].
Патогенез порока сложен, приводятся многочисленные, частично противоречивые теории. Преимущественное признание имеет концепция, согласно которой пороку развития сосуда предшествует появление аберрантной артерии. Через этот сосуд отшнуровываются и фиксируются единичные или множественные зародыши развивающегося бронхиального дерева. При секвестрации часть легочной ткани, обычно аномально развитой и представляющей собой кисту или группу кист, оказывается отделенной от нормальных анатомо-физиологических связей (бронхи, легочные артерии) и васкуляризуется артериями большого круга кровообращения, отходящими от аорты. Масса нефункционирующей эмбриональной или кистозной ткани, не имеющей связи с функционирующими дыхательными путями и снабжаемой кровью из большого круга кровообращения, носит название секвестра. Несмотря на то, что в большинстве случаев секвестры не сообщаются с функционирующими воздухоносными путями, это не является правилом. Как внутри, так и внедолевые секвестры образуются по одному и тому же патоэмбриологическому механизму как рудименты дивертикула пищевода. Внутри секвестра может быть обнаружена ткань желудка или поджелудочной железы. Тератогенный период этого сложного порока относится к ранней эмбриональной фазе.
Выделяют следующие анатомические варианты:
1. Внутридолевую секвестрацию (киста или кисты легкого с аномальным кровоснабжением) (75 %);
2. Внедолевую секвестрацию (добавочное легкое, или доля, с аномальным кровоснабжением) с формированием добавочного недоразвитого органа (киста или группа кист) вне нормально функционирующего легкого и васкуляризацией первого артерией или артериями большого круга. (25%) [7].
При внутридолевой секвестрации изменения чаще всего локализуются в заднемедиальных сегментах отделе нижней доли левого (реже правого) легкого и представляют собой кисту или группу кист бронхогенного типа, выстланных изнутри цилиндрическим или многорядным плоским эпителием, первично не сообщающихся с бронхиальным деревом и заполненных слизистой жидкостью. К ним подходит артериальный сосуд, начинающийся чаще всего на боковой поверхности нисходящего отдела грудной аорты и проходящий в толще легочной связки. Венозный отток из аномально развитой зоны осуществляется через легочные вены. В кисте (или кистах) рано или поздно начинается нагноение. Клинические проявления возникают только после развития нагноительного процесса в кистозной полости (полостях). Характерен субфебрилитет, а после прорыва содержимого кисты в бронх — обильная слизисто-гнойная мокрота, иногда кровохарканье.
При внедолевой секвестрации аномальный участок легочной ткани появляется вне нормально развитого органа и может располагаться в плевральной полости, в брюшной полости или на шее. Рудиментарное легкое (доля) имеет небольшие размеры и аномальное артериальное кровоснабжение за счет сосуда, отходящего от аорты или от другой крупной артерии большого круга. Его строение также чаще бывает кистозным, обычно не имеющим сообщения с воздухоносными путями. Внедолевая секвестрация клинически не проявляется и обнаруживается случайно во время операций или при патологоанатомическом исследовании, инфекционный процесс возникает редко [6, 8].
Выделяют 3 клинико-рентгенологические формы легочной секвестрации:
1. бронхоэктатическую, при которой после повторных воспалений и расплавления пограничной легочной ткани вторично возникает сообщение с бронхиальным деревом;
2. псевдотуморозную, характеризующуюся бедностью симптоматики;
3. форму, принимающую характер абсцесса или эмпиемы, при которой вследствие инфекции в области секвестра возникает гнойное воспаление легкого или эмпиема плевры [4, 6, 9, 10, 11, 12].
Диагностика:
Физикальное исследование обычно малоинформативно. Иногда удается определить влажные разнокалиберные хрипы в задненижних отделах одного из легких. При сообщении полостей недоразвитого легкого с воздухоносными путями распознаванию способствует бронхография. Показаны также аортография, поиск и селективное контрастирование аномальной артерии.
Рентгенологическое исследование позволяет определить кисту или группу кист с горизонтальным уровнем жидкости или без такового в медиально-базальном отделе одной из нижних долей. По периметру кист в период обострения может выявляться умеренная инфильтрация легочной ткани. Иногда же в этом отделе легкого определяется неправильной формы затенение, на фоне которого при томографическом исследовании можно выявить полость [11,12,13].
Лечение:
Легочная секвестрация требует хирургического вмешательства, которое часто сводится к клиновидной резекции секвестрированного участка. Она показана и в бессимптомных случаях, так как в секвестре развивается рецидивирующее воспаление [15].
Приводимый в качестве примера клинический случай демонстрирует внутридолевую секвестрацию нижней доли правого легкого у молодого мужчины с повторными пневмониями.
Пациент К., 28 лет обратился за амбулаторной помощью к врачу терапевту с жалобами на боли колющего характера в грудной клетке справа, субфебрилитет, слабость, кашель с небольшим количеством мокроты слизистого характера. В течение последних 5 лет ежегодно госпитализировался по поводу рецидивирующей правосторонней нижнедолевой пневмонии, без существенного эффекта от проводимого лечения. Консультирован фтизиатром, данных за туберкулез легких не получено.
На обзорной рентгенограмме органов грудной клетки выявлена правосторонняя нижнедолевая очаговая сливная пневмония. Пациент направлен в стационар МСЧ 41 для дальнейшего лечения, проведенный курс терапии без значимого эффекта. Бронхологическая картина (ФБС) без особенностей (фото 1, 2).

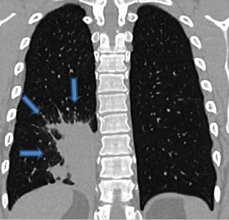
В качестве уточняющего метода диагностики рекомендована компьютерная томография (КТ) органов грудной клетки. КТ-картина характеризуется следующими изменениями:
Грудная клетка правильной формы симметричная. Во внутреннем и заднем нижних сегментах правого легкого (S 7,10) на фоне инфильтрации легочной ткани с локальными участками плевропневмофиброза определяется секвестр (рис. 1) с аберрантным сосудом (рис. 2) отходящим от грудной аорты (рис. 3, 4). По остальным легочным полям патологических изменений не определяется.
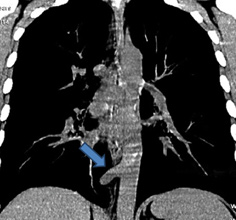
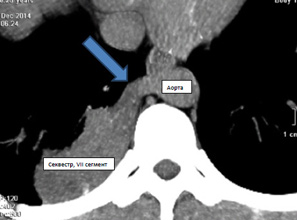
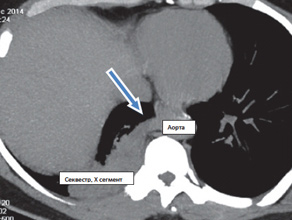
Бронхи нижней доли расширены, стенки их утолщены. Трахея и главные бронхи проходимы. Просветы бронхов свободны. Легочной рисунок усилен локально на уровне нижней доли справа. Жидкость в плевральных полостях не выявлена.
Сердце, грудной отдел аорты обычно расположены, не смещены. Внутригрудные лимфатические узлы единичные до 1.0 см., однородной структуры.
Со стороны костного остова: Умеренные дегенеративные изменения. Грыжа Шморля Th 10, склероз замыкательных пластинок тел позвонков. Позвоночный канал не сужен. Структура дурального мешка не изменена.
Заключение:
СКТ-картина: внутридолевая секвестрация заднемедиального отдела нижней доли правого легкого, хр. бронхит. Ограниченный правосторонний плевропневмофиброз. Данный случай характеризует редко встречающуюся аномалию развития, долгое время остававшуюся нераспознанной. Обращает на себя внимание факт рецидивирующих пневмоний у пациента в течение длительного времени, без значимого эффекта от проводимой терапии, что, тем не менее, не позволило клиницистам заподозрить порок, обнаруженный много лет спустя от момента начала клинических проявлений благодаря уточняющей методике (КТ). После разрешения пневмонии пациент был направлен в одну из клиник г. Москвы для решения вопроса о плановом хирургическом лечении.
Литература:
1. Pryce D. M. Lower accessory pulmonary artery with intralobar sequestration of lung: Report of 7cases. J Pathol Bacteriol 1946; 58:457–67.
2. Sade R. M., Clouse M. The Spectrum of Pulmonary Sequestration. Ann Thorac Surg 1974;18:644–58.
3. Felson B. Chest Roentgenology. Philadelphia: WB Saunders Company, 1973.
4. Felker R. E., Tonkin I. L. Imaging of pulmonary sequestration. AJR AmJRoentgenol1990;154:241–249.
5. Ko S. F., Ng S. H., Lee T. Y., Wan Y. L., Liang C. D., Lin J. W., Chen W. J., Hsieh M. J. Noninvasive Imaging of Bronchopulmonary Sequestration. AJR Am J Roentgenol2000; 175:1005–12.
6. Fraser R. S., Muller N. L., Colman N., Pare P. D. Fraser and Pare’s Diagnosis of Diseases of the Chest, 4thed, VolI. Philadelphia: WB Saunders Company,1999.
7. Savic B., Birtel F. J., Tholen W., Funke H. D., Knoche R. Lung sequestration: Report of seven cases and review of 540 published cases. Thorax 1979; 34:96–101.
8. Frazier A. A., Christenson M. L., Stocker J. T., Templeton P. A. Intralobar sequestration: Radiologic-pathologic correlation. Radiographics 1997;17:725–45.
9. Panicek D. M., Heitzman E. R., Randall P. A., Groskin S. A., Chew F. S., Lane E. J., Markarian B. Thecontinuum of pulmonary development anomalies. Radiographics1987; 7:747–59.
10. Rosado-de-Christenson M. L., Frazier A. A., Stocker J. T., Templeton P. A. Extralobar sequestration: Radiologic-pathologic correlation. Radiographics 1993;13:425–41.
11. Au VWK, ChanJKF, ChanFL. Case Report: Pulmonary sequestration diagnosed by contrast-enhanced three-dimensional MR-angiography. Br J Radiol 1999;72:709–11.
12. Ikezoe J., Murayama S., Godwin J. D., Done S. L., Verschakelen J. A. Bronchopulmonary Sequestration: CT Assessment. Radiology1990; 176:375–9.
13. Naidich D. P., Rumancik W. M., Ettenger N. A., Feiner H. D., Harnanz-Schulman M., Spatz E. M., Todar S. T., Genieser N. B. Congenital Anomalies of the Lungs in Adults: MR Diagnosis. AJR Am J Roentgenol1988; 151:13–9.
14. Halkic N., Cuenoud P. F., Corthesy M. E., Ksontini R., Boumghar M. Pulmonary sequestration: areview of 26cases. EurJCardiothoracSurg.1998;14:127–33.
15. Tokel K., Boyvat F., Varan B. Coil embolization of pulmonary sequestration in two infants: a safe alternative to surgery. AJR AmJRoentgenol.2000;175:993–95.
16. Clements B.S, Warner J. O. Pulmonary sequestration and related congenital bronchopulmonary-vascular malformations: nomenclature and classification based on anatomical and embryological considerations.Thorax.1987; 42:401–08.

