Эндоскопическая система поддержки принятия решения в диагностике патологии желудка:
основные этапы разработки и результаты экспериментального тестирования
Куваев Р. О. 1, Никонов Е. Л. 2, Кашин С. В. 1, Дунаева О. А. 3, Малкова Д. Б. 3, Эдельсбруннер Х. 4, Капранов В. А. 5, Ушаков А. Ю. 5
1 ГБУЗ Ярославской области «Клиническая онкологическая больница», отделение диагностической и терапевтической
эндоскопии, г. Ярославль
2 Управление делами и координации деятельности департамента здравоохранения г. Москвы
3 Международная научно-исследовательская лаборатория «Дискретная и вычислительная геометрия» им. Б. Н. Делоне
Ярославского государственного университета им. П. Г. Демидова, г. Ярославль
4 Институт Науки и Техники Австрии, г. Клостернойбург
5 Университетский центр Интернет, Ярославский государственный университет им. П. Г. Демидова, г. Ярославль
Актуальность:
Внедрение в медицинскую практику новых высокотехнологичных методов эндоскопической диагностики, таких как увеличительная и узкоспектральная эндоскопия, направлено на выявление ранних форм рака и предраковой патологии, что позволяет проводить высокоэффективное лечение. Однако, учитывая сложность структуры слизистой оболочки и ее изменений, диагностика с использованием этих методик является трудной задачей, требующей от специалиста высокого уровня профессиональной подготовки. При этом наиболее сложную микроархитектонику имеет слизистая оболочка желудка, поскольку в отличие от других отделов ЖКТ, при эндоскопическом осмотре требуется в равной степени оценка как микрососудистого рисунка, так и рисунка микроструктуры поверхности эпителия. Более того, слизистая оболочка желудка имеет три типа желез, имеющих различное строение, а большой спектр возможных патологических процессов (хроническое воспаление, атрофия, кишечная метаплазия, различные гистологические типы рака желудка) определяет разнообразие изменений в структуре слизистой оболочки [3]. Таким образом, эффективное использование этих эндоскопических методик требует внедрения экспертной поддержки диагностического процесса и новых подходов к обучению специалистов. В настоящее время применение систем поддержки принятия решения (СППР) в медицине позволяет быстро и эффективно использовать самые современные методики диагностики и решать сложные клинические задачи даже в условиях ограниченности временных ресурсов, недостатка знаний и опыта специалиста, в отсутствие возможности привлечения компетентных экспертов. Большинство разработок эндоскопических СППР (около 53 % всех опубликованных научных работ) посвящено диагностике патологии толстой кишки, прежде всего колоректальных полипов [1]. Учитывая особенности увеличительной диагностики в желудке, научные данные о СППР для диагностики патологических состояний желудка весьма ограничены. Более того, на сегодняшний день не разработано СППР для увеличительной эндоскопии с использованием наиболее изученной и эффективной методики виртуального контрастирования — узкоспектральной эндоскопии. Целью настоящего исследования явилась разработка и экспериментальное тестирование программного комплекса поддержки принятия клинического решения при проведении увеличительной и узкоспектральной эндоскопии у пациентов с патологией желудка.
Материал и методы исследования:
Для решения поставленных задач было обследовано 96 пациентов (из них мужчин — 54 (56,2 %), женщин — 42 (43,8 %), средний возраст 51,3±12,1 лет) с помощью эндоскопии с увеличением в узком спектре света (видеоэндоскоп Olympus GIF-Q160Z, эндоскопическая система Olympus EVIS Exera II, видеоэндоскоп Olympus GIF-Q260Z, эндоскопическая система Olympus EVIS Lucera). При обнаружении патологического участка проводился его детальный осмотр в узком спектре света с оптическим увеличением с последующим фиксированием эндоскопического изображения и выполнением биопсии для гистологической верификации патологического процесса. Для классификации патологических образований с помощью увеличительной эндоскопии использовалась современная интегральная классификация рисунков слизистой оболочки желудка (Pimentel-Nunes P., с соавт.), разработанная ведущими европейскими, японскими и североамериканскими экспертами на основе известных классификационных систем, которая предполагает деление на тип А (регулярный округлый), тип В (регулярный тубуло-виллёзный), тип С (нерегулярный) [2]. Эта классификация позволяет эффективно прогнозировать гистологические изменения (доброкачественные неметапластические, метапластические, неопластические образования), и соответственно им определять стратегию дальнейшего ведения пациента.
База данных эндоскопических изображений:
Все 180 выявленных патологических образований были занесены в специально созданную базу данных (свидетельство о государственной регистрации баз данных в Реестре баз данных Федеральной службы по интеллектуальной собственности № 2013620423), содержащую информацию о данных пациента, эндоскопическом исследовании, гистологическом заключении, а также эндоскопические изображения. Для обучения и тестирования программного комплекса поддержки принятия клинического решения из базы данных было выбрано 90 наиболее типичных для своего класса эндоскопических изображений, из них 25 — с округлым типом, 31 — с тубуло-виллезным типом и 34 — с нерегулярным типом.
Алгоритм автоматизированного анализа:
Авторами статьи был разработан специализированный «программный комплекс сегментации и аннотирования эндоскопических изображений» (свидетельство о государственной регистрации программы для ЭВМ 2014610971). Разработанный алгоритм автоматизированного анализа состоит из следующих этапов: предобработка изображения (выделение области засветов, выравнивание освещенности), генерация равномерно распределенных случайных точек, вычисление векторных дескрипторов для каждой точки, — набора характеристик, описывающих локальные свойств изображения (геометрические и топологические признаки), и собственно классификация изображения (выделяется этап обучения классификатора и этап сегментации нового изображения на уже обученном классификаторе). Для вычисления геометрических признаков сначала выделяется микрососудистый рисунок, строится бинарное изображение, на котором сосудам соответствуют светлые точки, а остальные точки считаются фоном. Затем по данному изображению вычисляются геометрические признаки, такие как площадь, периметр, радиус, вытянутость, компактность отдельных компонент связности. Уникальной особенностью работы является использование топологических характеристик изображения, что позволяет вычислять устойчивые признаки, которые не зависят от преобладания на изображении микрососудистого рисунка или рисунка поверхности эпителия. Последний этап алгоритма заключается в обучении классификатора, который на основе построенного вектора признаков позволяет отнести точку к одному из классов. В результате обработки эндоскопическое изображение разбивается на области, которым приписывается метка, определяющая тип рисунка (класс). Для визуального отображения работы классификатора на эндоскопическом изображении эти области окрашиваются в разные цвета. Пример автоматизированного анализа эндоскопического изображения с помощью разработанного программного комплекса показан на рисунке 1.

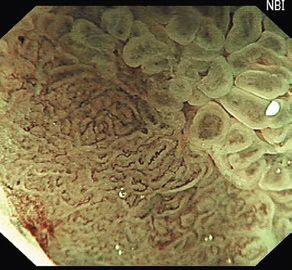

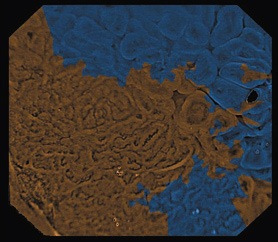
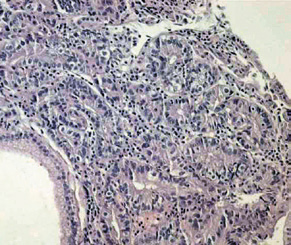
Рис. 1. Пример автоматизированного анализа эндоскопического изображения:
а - стандартное исследование;
б - осмотр в узком спектре света;
в - предобработка изображения с помощью программного комплекса: бинаризированное ч/б изображение;
г - результат анализа: область высокого риска рака выделена коричневым;
д - гистологическое исследование пострезекционного препарата: высокодифференцированная аденокарцинома, рост в пределах слизистой оболочки.
Обучение и результаты тестирования классификатора:
Для обучения программы-классификатора и тестирования разработанного алгоритма классификации использовались два метода генерации повторных выборок («численного ресэмплинга»): перекрестная проверка (кросс-валидация) с исключением (leave-one-out crossvalidation — LOO-CV) и бутстреп (bootstrap)-процедура (рисунок 2). При перекрестной проверке с исключением из 90 эндоскопических изображений только одно изображение использовалось в качестве тестового, а остальные 89 из исходного набора — в качестве обучающей выборки. При этом цикл повторялся, пока каждое изображение не будет использовано один раз в качестве тестового. Во время бутстреп-процедуры данные делились 10 раз на обучающую выборку из 75 изображений и тестовую выборку из 15 изображений. Результаты тестирования показали, что в большинстве случаев изображения имели высокий процент (90–100 %) правильно распознанных областей (рисунок 3). Средний показатель правильного распознавания составил 89±4,4 %.
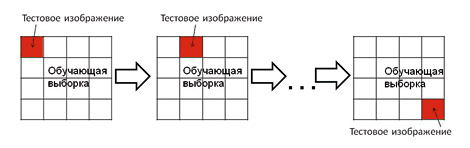

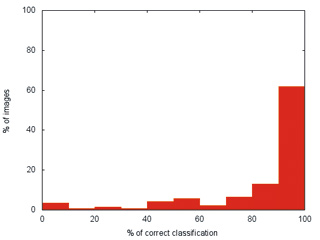
Рис. 3. Результаты тестирования:
а - с помощью метода перекрестной проверки с исключением (leave - one - outcross - validation – LOO - CV);
б - с помощью бутстреп (bootstrap)-процедуры
Выводы:
Разработанный программный комплекс автоматизированной обработки эндоскопических изображений позволяет эффективно распознавать три типа рисунка слизистой оболочки, соответствующих основным группам гистологических изменений желудка (доброкачественные неметапластические, метапластические, неопластические образования). Помимо этого, используемый классификатор позволяет картировать эндоскопическое изображение и идентифицировать области с разными типами рисунка, обозначая демаркационную линию между ними, что имеет огромное значение в определении точных границ патологических участков и, как следствие, планирования правильного лечения (медикаментозного, эндоскопического, хирургического). Использование этого программного комплекса при проведении увеличительной и узкоспектральной эндоскопии может обеспечить экспертную поддержку специалиста в принятии клинического решения, а также проводить быстрое и эффективное обучение новым эндоскопическим технологиям.
Список литературы:
1. Liedlgruber M., Uhl A. Predicting pathology in medical decision support systems in endoscopy of the gastrointestinal tract//Efficient Decision Support Systems — Practice and Challenges in B iomedical Related Domain, InTech, Rijeka, Croatia, 2011, p 195–214
2. Pimentel-Nunes P., Dinis-Ribeiro M., Soares J. B ., MarcosPinto R., Santos C., Rolanda C., B astos R. P., Areia M., Afonso L., B ergman J., Sharma P., Gotoda T., Henrique R., Moreira-Dias L. A multicenter validation of an endoscopic classification with narrow band imaging f or gastric precancerous and cancerous lesions//Endoscopy, 2012; 44, p. 236–246
3. Rey J‑F, Lambert R., Aabakken L., et al. Proceedings Of A Preliminary Workshop At Gastro 2009 — Narrow B anding Imaging In Digestive Endoscopy: Clinical Outcome Of Classification (OMED-JGES Educational Meeting Held On 22 November, 2009)//Digestive Endoscopy, 2011, 23, p. 251–266.

