ОСЛОЖНЕНИЯ ЭНДОСКОПИЧЕСКОГО СТЕНТИРОВАНИЯ ПИЩЕВОДА:
МЕТОДИКА КОНТРОЛЯ, ПРИЧИНЫ ВОЗНИКНОВЕНИЯ, ЭФФЕКТИВНАЯ КОРРЕКЦИЯ
М. П. Королев, Л. Д. Роман, Л. Е. Федотов, А. А. Смирнов, Р. М. Лукьянчук
ГОУВПО Санкт-Петербургская Государственная Педиатрическа Медицинская Академия, СПБГУЗ «Мариинская больница», Ленинградский Областной Онкологический Диспансер
г. Санкт-Петербург
В настоящее время эндоскопическое стентирование является методикой выбора при лечении дисфагии вызванной распространенным раком пищевода, кардии. Начиная с 2004 года нами были установлены саморасправляющиеся пищеводные стенты 192 больным с клиникой дисфагии. Из них 117 больных раком пищевода (70 %), 25 гастроэзофагеальным раком (13 %), 20 по поводу рецидивов рака в области пищеводного анастомоза (10,5 %), 13 с пищеводно-респираторными свищами (6,8 %), 5 с компрессией пищевода извне (2,6 %), а также 6 случаев доброкачественных стриктур пищеводных анастомозов (3,1 %), 2 с рубцовыми послеожеговыми стриктурами пищевода (1 %), 2 с несостоятельностью эзофагоэнтероанастомоза (1 %), 1 с постлучевой стриктурой пищевода (0,5 %), 1 с кардиоспазмом (0,5 %). У подавляющего большинства больных с дисфагией уже на следующие сутки после стентирования, появлялась возможность приема жидкой и полужидкой пищи, а через 3-5 суток явления дисфагии полностью исчезали. Особо выраженный эффект наблюдали при неопухолевых стриктурах. При выполнении стентирования по поводу эзофагореспираторных свищей удавалось во всех случаях добиться герметизации пищевода с исчезновением симптомов аспирации. У 100 % пациентов подвергшихся стентированию наблюдалось улучшение проходимости в области сужения. Помимо положительных результатов в виде снижения степени дисфагии, нами были зафиксированы осложнения, какнезначительные, так и значимые, потребовавшие эндоскопической или оперативной коррекции, общий процент последних составил 10,9 %(диаграмма 1).
Диаграмма 1. Структура осложнений
По нашим наблюдениям более 90 % больных испытывали боли в грудной клетки, которые мы связывали с давлением стента на ткани. У подавляющего большинства (96 %) болевые ощущения купировались на фоне симптоматической терапии, однако у 3 больных, боли сохранялись в течении недели. Также у нескольких (6) больных после установки стента развилась рвота, что поначалу мы связывали с нарушением проходимости стента, однако у всех больных рвота носила рефлекторный характер. У всех больных рвота купировалась до 3-4 суток. Появление изжоги отметили 3 больных, у которых стенты были установлены в зону кардии и не имели антирефлюксных клапанов. Из значимых осложнений, требующих нашего вмешательства, в первую очередь стоит отметить миграцию стента. Все случаи миграции (7) были разделены нами на ранние (4), т. е. произошедшие в первые несколько суток после установки стента, и поздние (3) – после выписки больного из стационара. По направлению смещения стента нам встречалась дистальная (6) и проксимальная (1) миграция стента. Накопленный нами опыт позволил тщательнее относиться к выбору стента, что привело к снижению уровня миграции в последние годы. За 3 последних года (2008,2009,2010) мы отметили лишь один случай смещения стента. Что касается механизма ранней миграции стента, то она, как правило, был связана с неудовлетворительной фиксацией стента в тканях, либо по причине слабой выраженности стриктуры, либо за счет ее излишней дилатации перед установкой стента. Во всех случаях факт миграции был установлен на 1-3 сутки, протезы были эндоскопически извлечены, и вновь установлены в область сужения. У одного больного после извлечения мигрировавшего протеза через «лассо» была проведена фиксирующая нить, которая затем, после фиксации вызвала «сборивание» стента, а соответственно сужение его проксимальной муфты. Немедленное удаление мигрировавших стентов мы считаем обязательным условием, так как при прохождении в нижележащие отделы он может вызвать как кишечную непроходимость (1 случай), так и перфорацию тонкой и толстой кишки. Для профилактики ранней миграции при недостаточно выраженном сужении мы применяем трансназальную фиксирующую нить, что является одной из причин уменьшения числа миграций в последние годы. Два случая поздней миграции произошли в течении 1 месяца после стентирования, а один из них был вызван по нашему мнению редукцией опухоли на фоне лучевой терапии. В последнем же случае стент находился в пищеводе в течении длительного времени (более 6 месяцев) и подвергся деструкции, что может быть одним из факторов риска.
Некроз пищевода был встречен нами дважды, в обоих случаях это произошло на фоне проведения лучевой терапии, и непосредственно привело к смерти одного из больных от медиастенита. Грануляционный стеноз, т. е. сужение просвета стента, за счет грануляционной ткани по краям стента был встречен у 4 больных, во всех случаях развивался на фоне длительного стояния стента в пищеводе – более 6 месяцев. Во всех случаях удавалось эндоскопически устранить явления нарушения проходимости в области стента, в одном случае установкой второго стента. Также нами была отмечена непроходимость в области стента по другим причинам, а именно: механическое повреждение стента – перелом, дальнейшее разрастание опухоли с перекрытием просвета стента – 2 больных. Дисфагию за счет разрастания опухоли из-под стента мы устраняли установкой второго стента в просвет первого с перекрытием места стеноза. У одного больного в результате нарушения диеты, стент был полностью обтурирован куском мяса, что потребовало извлечения эндопротеза. Деструкция стента также являлась поздним осложнением и диагностирована у 3 больных. Во всех случаях производилось удаление отломков стентов с целью предотвращения их миграции. В одном случае разрушение стента произошло на фоне проводимой лучевой терапии.
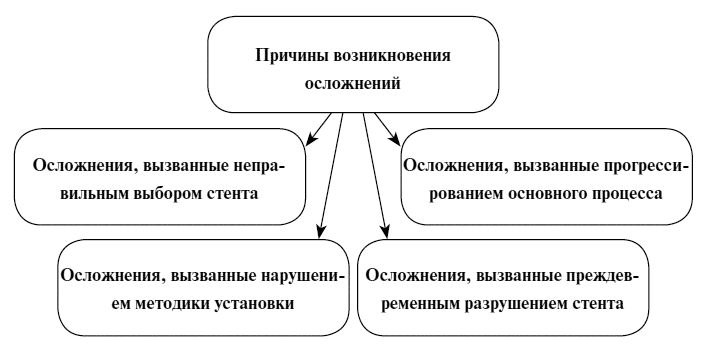
Ниже приведена диаграмма 2, в которой наглядно представлены все встреченные нами осложнения. Все осложнения были проанализированы и выделены 4 основных группы причин их возникновения. К первой группе относились ошибки при выборе стента. Сюда мы включили все ошибки при выборе типа стента, его длины, диаметра и дополнительных механизмов. Ошибки эти считали наиболее грубыми и приводящими к развитию осложнений. К примеру выбор недостаточно длинного стента приводит к раннему нарушению проходимости стента за счет разрастания опухоли. Индивидуальный подход при подборе стента позволяет нам избежать большинства осложнений, связанных с ошибками этой группы. Вторая большая группа причин осложнений объединяет все ошибки при установке стента, как ошибки проведения струны (перфорации, отслойки слизистой), так и ошибки при реканализации стриктуры перед стентированием (недостаточная, избыточная реканализация). В эту же группу мы включили ошибки уровня раскрытия стента (низкий, высокий). Ошибки при выборе анестезии также были включены в эту группу. Разработанная нами методика позволяла в большинстве случаев либо избежать этих ошибок, либо купировать их во время стентирования, либо в ближайшее время после окончания манипуляции. К третьей группе были отнесены те осложнения, которые возникли в связи с преждевременным разрушением стента, приведшим к возвращению симптомов дисфагии. Данные причины не всегда могут прогнозироваться, однако по нашему мнению применение лучевой терапии после установки стента, может приводить к уменьшению срока службы последнего. Четвертая же группа причин наименее прогнозируемая, так как включает осложнения возникшие в связи с прогрессированием опухолевого процесса и возникающими на этом фоне миграцией, некрозом, кровотечением и непроходимостью в области стента. Однако, по нашему мнению также существует связь между проведением лучевой терапии и увеличением количества осложнений. В диаграмме 2 наглядно представлены причины возникновения осложнений.
Диаграмма 2. Причины возникновения осложнений стентирования
Разработанный нами алгоритм выполнения рентгенологического контроля после стентирования позволил эффективно и в короткие сроки выявлять осложнения, возникающие во время манипуляции или в первые дни после стентирования. Все осложнения, возникшие в ранние после имплантации стента сроки были устранены при помощи эндоскопии. Анализ полученных осложнений, позволил в последующем в большинстве случаев избегать их возникновения. В большей степени поддавались коррекции ошибки, относящиеся к первой и второй группам. Отмечена также тенденция увеличения количества осложнений при проведении в последующем лучевой терапии на область опухоли и стента. Излучение по нашему мнению оказывает влияние не только на опухоль, вызывая ее некроз и редукцию (фактор риска миграции стента, перфорации пищевода), но также и на сам стент, что приводит к нарушению его целостности. Следствием же нарушения конструкции стента помимо того, что он прекращает выполнять свою основную функцию по поддержанию адекватного просвета пищевода в области патологического очага, является миграция фрагментов с развитием таких грозных осложнений как кишечная непроходимость, перфорация кишки, перитонит, кровотечение. Осложнения же относящиеся к третьей и в особенности четвертой группам достаточно трудно прогнозировать. Прогрессирование опухолевого процесса рано или поздно приводит к возникновению описанных выше осложнений, поэтому нам оставалось только при их возникновении проводить коррекцию для восстановления проходимости просвета стента и пищевода имеющимися у нас средствами (аргоноплазменная коагуляция, эндоскопическая коррекция положения, рестентирование).
Проведенное исследование показывает, что эндоскопическое стентирование может быть применено у больных с различными стенозирующими заболеваниями пищевода, которым не показано радикальное оперативное лечение по ряду причин. Причинами отказа от оперативного лечения может явиться как распространенность опухолевого процесса или крайняя тяжесть состояния больного, так и операбельное поражение пищевода, сочетающееся с тяжелой сопутствующей патологией. Тщательное предоперационное обследование больных с применением не только рентгена и эзофагоскопии, но также компьютерной томографии, бронхоскопии в комплексе с оценкой соматического статуса больного позволяет не только правильно определить показания к эндоскопическому стентированию, но и является предпосылкой для индивидуального подбора оптимального стента. За время проведения исследования мы отказались от сочетанной рентген-эндоскопической установки стентов в пользу исключительно эндоскопической методики, которая применялась в большинстве случаев (177). Следует отметить, что антеградное проведение струны не всегда удавалось, и в 2 случаях приходилось использовать ретроградный способ проведения проводника.
Рентгеновские снимки пищевода с к. в. выполнялись в различные сроки, которые зависели от успеха стентирования. Было установлено, что выполнение рентгенограмм в день стентирования позволяет обнаружить такое раннее осложнение эндопротезирования, как перфорация пищевода. Выполнение снимков в более поздние сроки давало возможность оценить не только оценить фиксацию стента в тканях, но также и степень раскрытия эндопротеза. Следует отметить, что выполнение рентгенограмм в более поздние сроки давало более полное представление об эффективности раскрытия стента. Такой подход к контролю результатов стентирования позволил своевременно диагностировать большинство осложнений, которые в большинстве своем были разрешены при помощи эндоскопии. Анализ полученных осложнений позволил выявить те причины, воздействие на которые может улучшить результаты. К этим причинам относятся ошибки при выборе стента, а также нарушения методики установки. В значительно меньшей степени поддавались коррекции те осложнения, причинами которых явилось прогрессирование основного процесса, а также разрушение стента.
Выводы:
- Общий процент осложнений составил 10,9 %.
- Проведение дифференцированного рентген-эндоскопического контроля на 1-3 сутки позволяет своевременно выявить возникающие осложнения.
- Более чем в 90 % случаев использование современных эндоскопических методов позволяет корригировать возникающие осложнения, кроме тех, которые связаны с прогрессированием основного процесса.