СРАВНИТЕЛЬНАЯ ОЦЕНКА ГАСТРОСТОМИИ И ЭНДОПРОТЕЗИРОВАНИЯ ПИЩЕВОДА САМОРАСШИРЯЮЩИМИСЯ СТЕНТАМИ ПРИ ЕГО ОПУХОЛЕВОЙ ОБСТРУКЦИИ
С. В. Давыдова, А. Г. Фёдоров, А. Е. Климов, кафедра факультетской хирургии Российского университета дружбы народов (зав. – проф. А. Е. Климов)
А. С. Водолеев, ГКБ № 64
О. И. Юдин, Е. В. Иванова, Е. В. Горбачёв, Е. Д. Фёдоров, НОЦ абдоминальной хирургии и эндоскопии РГМУ им. Н. И. Пирогова (зав. – проф. С. Г. Шаповальянц), ГКБ № 31 (гл. врач – член-корр. РАМН, проф. Г. Н. Голухов)
г. Москва
Введение:
Злокачественная обструкция пищевода нередко развивается при запущенном онкологическом заболевании, когда радикальное вмешательство невозможно из-за распространённости опухолевого процесса или тяжёлого общего состояния пациента. Выполняемая в таких условиях традиционная паллиативная операция в объёме гастростомии сопровождается достаточно высоким риском развития осложнений. При этом одним из главных негативных последствий операции является лишение пациента возможности питания естественным путём. В последние десятилетия альтернативой гастростомии всё чаще становится методика эндопротезирования пищевода, получившая широкое распространение после внедрения в клиническую практику металлических саморасширяющихся стентов.
Цель исследования:
Провести сравнительный статистический анализ непосредственных результатов гастростомии и протезирования пищевода саморасширяющимися стентами по результатам работы двух клинических центров г. Москвы – хирургических клиник РУДН (ГКБ № 64) и РГМУ им. Н. И. Пирогова (ГКБ № 31).
Материал и методы:
В основу ретроспективного нерандомизированного исследования положен анализ клинического наблюдения 106 пациентов, которым в период с 1999 по 2011 гг. были выполнены паллиативные вмешательства по поводу злокачественной обструкции пищевода.
Первую группу составил 51 пациент, которым в период 1999-2005 гг. наложены гастростомы; вторая группа представлена 55 пациентами, которым в период с 2003 по январь 2011 гг. выполнено стентирование.
Группы явились сопоставимыми по полу, возрасту, физикальному статусу и тяжести симптомов обструкции. У подавляющего большинства пациентов обеих групп была выявлена 4 стадия онкологического заболевания. Средний возраст в I и II группах составил 67,0±12,0 и 66,8±12,2 лет, соотношение мужчин и женщин – 38/13 и 36/19 соответственно. Средняя продолжительность симптомов дисфагии (медиана) в I группе была 60 (интерквартильный размах от 21 до 90) суток, во II – 80 (от 60 до 90) суток; видимое различие при этом не явилось статистически значимым (p=0,0671, U-критерий Манна-Уитни).
Причиной злокачественной обструкции пищевода явились: опухоль пищевода (32 в I группе/36 во II группе), опухоль желудка с распространением на пищевод (15/17), метастазы рака молочной железы в лимфатические узлы средостения (1/1), рецидив рака желудка в области эзофагогастроанастомоза (1/0), рецидив рака лёгкого (1/0), рецидив рака гортани (1/0), распространённая опухоль поджелудочной железы со сдавлением кардии и абдоминального отдела пищевода (0/1).
В I группе выполнены гастростомии по Кадеру (39), по Витцелю (10), по Топроверу (1) и лапароскопическая гастростомия (1). Операции были проведены у 25 пациентов под внутривенной анестезией, у 18 – под эндотрахеальным наркозом и у 8 – под местной анестезией.
Во II группе для восстановления энтерального питания пациентам было имплантировано 56 саморасширяющихся пищеводных стентов: покрытый Gianturco-Rösch Z-stent (1), Z-stent с непокрытой воронкой (1), покрытые CHOOSTENT (16, в том числе 1 шейный стент) и HANAROSTENT (38, из них 31 с антирефлюксным клапаном). Z-stent (Wilson-Cook® Medical Inc., USA) изготовлен из нержавеющей стали, CHOOSTENT и HANAROSTENT (M. I. Tech Co., Ltd,
Korea) – из нитинола. Вмешательство проводили под нейролептаналгезией с сохранением сознания у 30 пациентов, под внутривенной анестезией с сохранением спонтанного дыхания – у 25 пациентов.
Имплантацию стентов выполняли под рентгенологическим и эндоскопическим контролем. После контрастирования для уточнения локализации и протяжённости стриктуры устанавливали накожные рентгеноконтрастные метки для облегчения ориентировки при раскрытии стента. В 17 случаях выполнялась баллонная дилатация, в 7 – бужирование опухолевой стриктуры. Через биопсийный канал эндоскопа дистальнее сужения заводили струну-проводник (Рис.1), после чего эндоскоп извлекался. По струне проводили доставочное устройство и осуществляли высвобождение стента. Затем выполнялся рентгенологический и эндоскопический контроль (Рис. 2, 4, 5, 6) и, при необходимости, коррекция положения стента (Рис. 3).
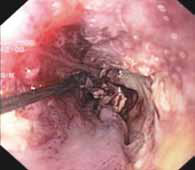




В одном случае опухоли пищевода с наличием двух участков стеноза в грудном и шейном отделах, с формированием пищеводно-бронхиального свища, с деформацией и сужением трахеи было выполнено сочетанное протезирование трахеи и пищевода. Вмешательство провели в два этапа. Вначале было выполнено эндопротезирование трахеи. Затем через 4 дня имплантированы 2 покрытых пищеводных стента: вначале в грудной отдел пищевода, затем стент шейной модификации в область проксимальной стриктуры.
Результаты:
После гастростомии осложнения отмечены в 10 (25,6 %) случаях. Из них специфические (связанные с техническими особенностями вмешательства) осложнения наблюдались у 6 (15,4 %) пациентов: несостоятельность гастростомы (3), выпадение гастростомической трубки (1), раневая инфекция (2). Неспецифические осложнения имели место в 4 (10,3 %) случаях: острая печёночно-почечная недостаточность (1), пневмония (3).
После стентирования отмечено 6 (10,9 %) осложнений. Специфические осложнения развились в 5 (9,1 %) случаях. У 2 пациентов отмечена миграция стента: в одном случае частичная миграция шейного стента с некрозом опухоли по краю эндопротеза (выполнена коррекция положения стента), во втором случае – полная миграция пищеводного стента в желудок (стент успешно возвращён в прежнее положение путём тракции за предназначенное для этих целей лассо). В 3 случаях развились серьёзные осложнения: перфорация пищевода при баллонной дилатации (область перфорации герметично закрыта раскрывшимся покрытым пищеводным стентом); прорыв ранее существовавшего абсцесса средостения в плевральную полость при распространённой опухоли пищевода с прорастанием в заднее средостение, септический шок с летальным исходом на 4 сутки; кровотечение из пищеводно-бронхиального свища с дефектом в заднее средостение, с аррозией межрёберной артерии с летальным исходом на 6 сутки. Отмечено также 1 неспецифическое осложнение (1,8 %) в виде острого инфаркта миокарда.
Летальность в период пребывания в стационаре после гастростомии составила 35,3 % (18 пациентов), после стентирования – 9,1 % (5 пациентов).
Средняя длительность пребывания больных в стационаре (медиана, интерквартильный размах) после гастростомии составила 17 (от 13 до 22) суток, после стентирования – 13 (от 10 до 21) суток.
При сравнении непосредственных результатов не выявлено статистически значимых различий в количестве осложнений (p=0,1640, точный критерий Фишера), однако более высокая летальность в хирургической группе явилась статистически высокозначимой (p=0,0010, точный критерий Фишера). Различие в длительности пребывания пациентов в стационаре также явилось статистически значимым (p=0,0241, U-критерий Манна-Уитни) (Таблица 1).
Таблица 1. Сравнение результатов гастростомии и эндопротезирования пищевода
| Гастростомия | Эндопротезирование | Статистическое сравнение* |
|
| Количество пациентов | 51 | 55 | |
| Осложнения | 10 (25,6 %) | 6 (10,9 %) | p=0,1640 точный критерий Фишера |
| специфические | 6 (15,4 %) | 5 (9,1 %) | p=0,4464 |
| неспецифические | 4 (10,3 %) | 1 (1,8 %) | p=0,1588 |
| Летальность | 18 (35,3 %) | 5 (9,1 %) | p=0,0010 точный критерий Фишера |
| Среднее количество койко-дней (медиана, интерквартильный размах) |
17 (от 13 до 22) суток |
13 (от 10 до 21) суток |
p=0,0241 U-критерий Манна-Уитни |
*различие является статистически значимым при p<0,05 и высокозначимым при p<0,01
Выводы:
Эндоскопическое протезирование саморасширяющимися стентами при опухолевой обструкции пищевода сопровождается сопоставимым количеством осложнений и более низким уровнем летальности по сравнению с гастростомией. Применение методики эндопротезирования позволяется сократить время пребывания больных в стационаре. При этом одним из наиболее очевидных преимуществ и достоинств стентирования является сохранение возможности перорального питания, что существенно повышает качество жизни и позволяет рекомендовать протезирование саморасширяющимися стентами в качестве окончательного паллиативного метода лечения у неоперабельных пациентов.

