Стентирование главного панкреатического протока в лечении острого панкреатита, возникшего после эндоскопических ретроградных вмешательств
Проф., д. м. н. Шаповальянц С. Г.,
ст. н. с., к. м. н. Будзинский С. А.,
проф., д. м. н. Федоров Е. Д.,
доц., к. м. н. Мыльников А. Г.,
орд. Котиева А. Ю.
Российский национальный исследовательский медицинский университет имени Н. И. Пирогова: кафедра госпитальной хиругии № 2 ЛФ, НИЛ хирургической гастроэнтерологии и эндоскопии (зав. — проф. С. Г. Шаповальянц)
ГКБ № 31 (гл. врач — Р. А. Маслова)
Москва
Эндоскопические ретроградные транспапиллярные вмешательства заняли прочное место в структуре лечения пациентов с заболеваниями желчных путей и протоковой системы поджелудочной железы (ПЖ).
Обладая высокой клинической эффективностью, эти, широко применяемые вмешательства, несмотря на многократно подтверждённую малую травматичность, всё — таки имеют целый ряд серьезных, а иногда и фатальных осложнений, которые встречаются по данным литературы в 1–10 % случаев. К ним относятся: кровотечение из области эндоскопической папиллосфинктеротомии (ЭПСТ) или вирсунготомии (ВТ), перфорация стенки двенадцатиперстной кишки (ДПК), острый холецистит, восходящий холангит, проксимальная и дистальная миграция стентов и ряд других патологических состояний.
Однако, одним из самых грозных и, к сожалению, часто встречающихся осложнений, является развитие острого постманипуляционного панкреатита, который возникает в 1–3 % случаев при операциях по поводу холедохолитиаза и в 5–30 % случаев при выполнении эндоскопических ретроградных вмешательств на фоне папиллостеноза. В этих случаях основным патофизиологическим фактором развития острого панкреатита (ОП) является возникновение отека области вмешательства в проекции устья главного панкреатического протока (ГПП), что затрудняет отток панкреатического сока и является пусковым моментом развития ОП. Лечение данной категории пациентов является трудоемким, длительным и дорогостоящим. Вот почему стентирование ГПП в завершение ретроградного вмешательства на большом дуоденальном сосочке (БДС) активно используется во всём мире для профилактики ОП у пациентов входящих в группу высокого риска его развития. По общепринятым представлениям, риск развития острого постманипуляционного панкреатита повышается при наличии ряда факторов или их совокупности. При этом разделяют факторы, связанные непосредственно с эндоскопическим вмешательством и не связанные с ним. К первой группе принято относить выполнение баллонной папиллодилатации, атипичный (неканюляционный) характер ЭПСТ, большое количество попыток канюляции БДС и ряд других. Ко второй группе относят наличие у пациентов папиллостеноза или дисфункции сфинктера Одди, женский пол, нерасширенный желчный проток, молодой возраст и неизмененные показатели по данным биохимического анализа крови.
Отношение же к неотложным эндоскопическим ретроградным вмешательствам, позволяющим разрешить проблему нарушения оттока панкреатического секрета и прервать дальнейшую манифестацию клинических и лабораторно-инструментальных проявлений острого постманипуляционного панкреатита на ранних стадиях его возникновения, далеко не однозначное. Большинство западных специалистов выступают против повторного эндоскопического вмешательства в условиях развивающегося острого артифициального панкреатита, хотя это мнение не подтверждено результатами серьёзных клинических исследований.
Цель исследования
Ретроспективно оценить результаты эндоскопического ретроградного стентирования ГПП в лечении ОП, возникшего после эндоскопических транспапиллярных вмешательств.
Материалы и методы С 01.01.2009 по 01.01.2013 в нашей клинике было выполнено 1948 ретроградных эндоскопических вмешательств на желчном дереве и протоковой системе поджелудочной железы. При этом общее количество осложнений составило 23 (1,18 %), среди которых послеоперационное кровотечение из области ЭПСТ или ВТ встретилось в 4 (0,2 %) случаях, ретродуоденальная перфорация — в 3 (0,15 %), а ОП возник у 16 (0,8 %) больных.
При этом летальные исходы, имели место в 3 наблюдениях (0.15 %) Среди пациентов с развившимся постманипуляционным панкреатитом было 15 (93,75 %) женщин и 1 (6,25 %) мужчина. Средний возраст составлял 60,25 ± 12,57 лет. Показанием к эндоскопическим вмешательствам у данной группы больных во всех наблюдениях явилась механическая желтуха, причиной которой оказались: папиллостеноз в 8 (50 %) случаях, (в том числе в сочетании с холедохолитиазом в 2 наблюдениях), изолированный холедохолитиаз в 3 (18,75 %) случаях, парапапиллярные дитвертикулы — так же в 3 (18,75 %) наблюдениях (в том числе в сочетании с холедохолитиазом и папиллостенозом по 1 наблюдению), и рестеноз области ранее выполненной ЭПСТ у 1 (6,25 %) больной.
Острый панкреатит развился после изолированной ЭПСТ в 7 (43,75 %) случаях, после ЭПСТ с последующей литоэкстракцией в 5 (31,25 %) наблюдениях, а также после ЭПСТ с дополнительной ВТ у 3 (18,8 %) больных. При этом атипичная ЭПСТ была выполнена у 5 пациентов (33,3 %). Еще в 1 (6,25 %) случае острый панкреатит возник на фоне неудачной попытки канюляциии БДС с целью ЭРХПГ.
Острый панкреатит, у большинства больных из исследуемой группы, развивался в первые 12 часов после первичных эндоскопических ретроградных вмешательств — в 11 (68,75 %) случаях. В то же время, клиническая картина острого панкреатита появлялась через 12–24 часа в 3 (18,75 %) наблюдениях, а на 2-е сутки после первичной ЭПСТ — лишь у 2 (12,5 %) больных.
Основными клиническими проявлениями, заставившими заподозрить развитие острого панкреатита в ближайшем послеоперационном периоде, являлись: выраженный болевой синдром в эпигастральной области и правом подреберье с иррадиацией в спину, многократная рвота, гипертермия. Диагноз острого панкреатита был подтвержден лабораторными и инструментальными методами исследования (достоверно высокое повышение уровня амилазы от 882 до 12036 ед/л — у всех 16 (100 %) пациентов, характерные изменения при УЗИ брюшной полости — у 13 (81,3 %) (Рис. 1), КТ брюшной полости — у 8 (50 %) пациентов (Рис. 2).


Результаты:
В максимально ранние сроки после появления клинической картины острого постманипуляционного панкреатита (до 18 часов от манифестации клиники, но не более 1–1.5 суток от первичного ретроградного вмешательства) в 11 (68,8 %) случаях мы предприняли попытку эндоскопического стентирования ГПП. В 4 (25,0 %) случаях в виду легкой степени выраженности клинических проявлений ОП, от выполнения повторного эндоскопического вмешательства было решено воздержаться и больным проводилось консервативное лечение в объеме: инфузионной, антибактериальной, антисекреторной, спазмолитической, симптоматической терапии.
Еще в 1 (6,3 %) случае, учитывая молниеносный характер развившегося острого панкреатита и крайнюю степень тяжести пациента, от выполнения ретроградного панкреатического стентирования было решено воздержаться в пользу интенсивной консервативной терапии с последующим хирургическим вмешательством.
Техника панкреатического стентирования заключалась в следующем. При выполнении дуоденоскопии, мы оценивали состояние области ЭПСТ или БДС после ранее произведенного эндоскопического ретроградного вмешательства (Рис. 3).
После этого стремились селективно выполнить катетеризацию устья ГПП. Данная манипуляция была обычно осложнена наличием выраженного отека данной зоны. Мы ориентировались на типовое расположение устья ГПП в проекции пост-папиллотомической площадки. Как правило, устье Вирсунгова протока локализовано ниже и правее устья холедоха, которое после выполнения ЭПСТ определить обычно не составляет труда.
Канюляция во всех случаях осуществлялась по пластиковой струне-проводнику (рис. 4).
В случае успешного выполнения катетеризации ГПП с целью избежать контрастирования ГПП на фоне развивающегося острого панкреатита, в ряде наблюдений — 4 больных — верификация расположения инструментов осуществлялась под рентгенологическим контролем (РГ) в зависимости от характерного направления струны-проводника. Однако, в 5 наблюдениях для точного определения расположения проводника, мы прибегали к проведению панкреатикографии посредством введения в просвет ГПП небольшого количества контрастного вещества (1,5–2 мл), разбавленного раствором диоксидина в соотношении 3:1. При этом во всех случаях на панкреатикограмме определялось наличие умеренной панкреатической гипертензии (рис. 5).



После этого по струне с помощью толкателя выполнялась установка пластикового стента с целью возобновления адекватного оттока панкреатического сока, таким образом, чтобы проксимальный конец стента находился на 20–25 мм выше устья ГПП, а дистальный на 10–15 мм выступал в просвет 12 перстной кишки (рис. 6 А, Б). После адекватной установки панкреатического стента во всех случае по нему отмечалось обильное поступление вязкого панкреатического сока.
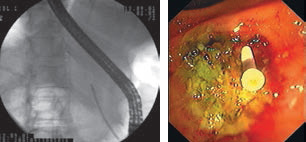
Рис. 6. Завершение установки панкреатического стента (А — РГ- картина, Б — эндофото). При выполнении панкреатикодуоденального протезирования мы использовали панкреатические стенты фирм Olimpus и WilsonCook диаметром 5 и 7 Фр и длиной от 3 до 5 см.
Выполнить протезирование Вирсунгова протока удалось в 9 (81,8 %) из 11 наблюдений, что позволило достичь восстановления адекватного оттока панкреатического сока и привело к выздоровлению пациентов во всех случаях. В остальных 7 наблюдениях, (в том числе в 2 случаях у больных с неудачной попыткой панкреатического стентирования), пациентам проводилась консервативная терапия. При этом в 2 наблюдениях в связи с неэффективностью консервативного лечения и прогрессирующим течением заболевания были проведены хирургические вмешательства в объеме некрсеквестрэктомии. Летальность в группе больных, которым панкреатическое стентирование выполнено не было, либо не удалось, составила 28,6 % (2 случая из 7).
Панкреатические стенты удалялись у пациентов в сроки от 5 до 12 суток после их установки. После извлечения стентов осложнений выявлено не было.
Заключение
По нашим данным, эндоскопическое стентирование ГПП, предпринятое в максимально ранние сроки от развития клиники острого постмапипуляционного панкреатита технически выполнимо в 81,8 % случаев. Панкреатическое стентирование является эффективным компонентом комплексного лечения — во всех наблюдениях после выполнения стентирования ГПП имел место выраженный положительный клинический эффект с последующим выздоровлением пациентов. В то же время летальность в группе больных, которым панкреатическое стентирование выполнено не было, либо не удалось составила 28,6 %. Полученные результаты заставляют более углублённо проанализировать применение раннего неотложного стентирования ГПП не только для профилактики, но и для лечения острого панкреатита, возникшего после эндоскопических ретроградных вмешательств.

