Результаты гастродуоденального и энтерального стентирования нитиноловыми эндопротезами при опухолевой обструкции
Годжелло Э. А. - д.м.н., главный научный сотрудник эндоскопического отделения ФГБУ «РНЦХ им. акад. Б.В. Петровского» РАМН,
Хрусталева М. В. - д.м.н., руководитель эндоскопического отделения ФГБУ «РНЦХ им. акад. Б. В. Петровского» РАМН,
Галлингер Ю. И. - д.м.н., профессор ФГБУ «РНЦХ им. акад. Б.В. Петровского» РАМН, Р. Д.
Шарипжанова - врач эндоскопического отделения ФГБУ «РНЦХ им. акад. Б.В. Петровского» РАМН,
Булганина Н. А. - к.м.н., научный сотрудник эндоскопического отделения ФГБУ «РНЦХ им. акад. Б.В. Петровского» РАМН,
Шатверян Д. Г. - к.м.н., старший научный сотрудник эндоскопического отделения ФГБУ «РНЦХ им. акад. Б.В. Петровского» РАМН,
Евдокимова Е. В. - врач эндоскопического отделения ФГБУ «РНЦХ им. акад. Б.В. Петровского» РАМН,
Титова И. В. - аспирант эндоскопического отделения ФГБУ «РНЦХ им. акад. Б.В. Петровского» РАМН
г. Москва
Нарушение эвакуации пищи из желудка довольно часто является основным симптомом опухолевого поражения гастродуоденальной зоны или сдавления извне двенадцатиперстной и начального отдела тонкой кишки вблизи связки Трейтца, свидетельствующим, к сожалению, о запущенности болезни. Оперативное лечение гастродуоденальной обструкции в виде обходных анастомозов у ослабленных больных сопровождается достаточно большой частотой осложнений и летальностью и не увеличивает значимо продолжительность жизни. Другой альтернативой у этих больных является формирование энтеростомы. Таким образом, хирургическое лечение рака желудка на данной стадии болезни оказывается паллиативным. В конечном счете, из-за плохого прогноза, короткой продолжительности жизни, значительной частоты осложнений и высокой летальности этому методу не должно отдаваться предпочтение в сравнении с менее инвазивными технологиями, к которым в настоящее время относится стентирование саморасправляющимися эндопротезами. В соответствии с локализацией поражения целесообразно называть эту группу паллиативных эндоскопических вмешательств гастродуоденальным и энтеральным стентированием.
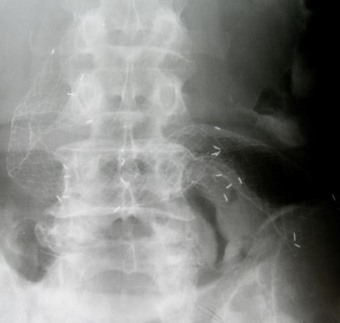
За период с 2007 г. по 2013 г. в Российском научном центре хирургии имени акад. Б.В. Петровского РАМН эндоскопическое гастродуоденальное и энтеральное стентирование нитиноловыми саморасправляющимися протезами было выполнено у 46 больных в возрасте от 44 до 87 лет; мужчин было 30, женщин - 16. Уровень и протяженность опухолевого стеноза были весьма разнообразными. У 5 пациентов был субтотальный или тотальный рак желудка без поражения привратника, в том числе имеющий инфильтративный рост. Протяженность значимого сужения (до 6‑7 мм) достигала 13‑14 см. В 7 наблюдениях опухоль захватывала пилорический канал, а у 6 переходила на двенадцатиперстную кишку вплоть до вертикального отдела, при этом двенадцатиперстная кишка в ряде случаев была фиксирована. У 1 пациента бластоматозное поражение желудка вовлекало кардию, а дистальная граница опухоли локализовалась в пилорическом канале или нижележащих отделах двенадцатиперстной кишки. Рецидив опухоли в культе желудка с переходом на пищевод, гастроэнтероанастомоз и отводящую петлю тонкой кишки с локализацией основной зоны сужения диаметром до 5 мм в области анастомоза и ниже него на протяжении 3-4 см был у 1 пациентки. Еще одну категорию представляли 12 пациентов с поражением только двенадцатиперстной кишки, начиная с луковицы и постбульбарного перехода и заканчивая вертикальным и нижнегоризонтальным отделами. У 10 из них обтурация просвета была обусловлена распространением бластоматозного поражения головки поджелудочной железы, холедоха, фатерова соска, желчного пузыря на различные отделы двенадцатиперстной кишки, при этом у 5 пациентов потребовалось двойное стентирование – желчевыводящих путей и двенадцатиперстной кишки, выполненное с интервалом от 2 до 12 месяцев (рис. 1). У оставшихся 2 из 12 больных было сдавление нижнегоризонтальной ветви двенадцатиперстной кишки и начального отдела тонкой кишки извне за счет основного процесса в соседних органах или метастатического поражения (например, у 1 из них - местный рецидив после неоднократного оперативного лечения первично-множественного рака толстой кишки, в конечном итоге - колэктомии с формированием J‑образного резервуара из тонкой кишки, правосторонней гемигепатэктомии и химиотерапии с прорастанием и сдавлением вертикального отдела двенадцатиперстной кишки на уровне нижнего изгиба). Еще у 12 больных стентирование было предпринято по поводу рецидива опухоли в зоне пищеводно-тонкокишечных анастомозов, при этом у 1 пациента было еще сдавление тонкой кишки на 10 см ниже анастомоза за счет метастатического поражения хвоста поджелудочной железы на протяжении 3-4 см. Это потребовало одномоментного стентирования двух зон поражения длинным эндопротезом. Еще у 1 пациента с признаками опухолевого роста в зоне эзофагоэнтероанастомоза определялись инфильтрация и сужение просвета кишки на 3‑4 см ниже анастомоза, а также значимый перегиб кишки на 7‑8 см ниже анастомоза, что также было необходимо учитывать при подборе длины стента. У оставшихся 2 больных после гастрэктомии в области пищеводно-тонкокишечного анастомоза патологических изменений не было, однако нарушение эвакуации было вызвано сдавлением тонкой кишки извне на 5 и 10 см ниже уровня анастомоза метастатическими лимфоузлами, а несколько ниже был выраженный перегиб петли кишки, который также оказался значимым препятствием для прохождения пищи. Таким образом, общая протяженность поражения отводящей тонкой кишки в обоих случаях составила 8 см.
 |
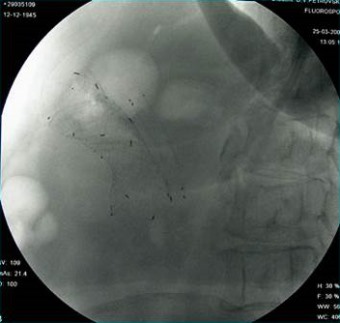 |
| Рис. 1. Двойное - билиарное и энтеральное - стентирование. Рентгенограмма | Рис. 2. Двойное пилородуоденальное стентирование в связи с неточным позиционированием первого стента. Рентгенограмма |
У 8 пациентов с целью подготовки к вмешательству за несколько дней до него установили назоэнтеральные зонды для питания. При стенозе постбульбарного перехода, вызванном продолженным ростом опухоли головки поджелудочной железы, для того чтобы провести эндоскоп в вертикальный отдел и вначале определиться с тактическими вопросами, касающимися введенного годом ранее саморасправляющегося билиарного стента, в 1 случае потребовалось несколько сеансов баллонной дилатации сужения, хотя обычно при поражении гастродуоденальной и энтеральной зон предварительное расширение не предпринимали. Перед стентированием эзофагоэнтероанастомозов у 6 из 12 пациентов выполнили бужирование до 30-36 бужей.
Для эндопротезирования использовались саморасправляющиеся стенты фирм ≪M.I.Tech≫, Ю.Корея (38), ≪Ella-CS≫, Чехия (14): пилородуоденальные (34), колоректальные (8), билиарные (1), пищеводные (9) – у 4 больных было введено по 2 стента, у 1 - 3 стента.
Только 11 стентов имели покрытие, 41 были непокрытыми. Все установленные стенты были изготовлены из нитинола, поскольку для безопасного преодоления изгибов кишечных петель и анатомических перегибов необходима большая гибкость в сочетании с достаточной расправляющей радиальной силой. Один из непокрытых пилородуоденальных стентов фирмы M.I. Tech (Ю. Корея) был двойного плетения, что обеспечивает, с одной стороны, бόльшую расправляющую силу, с другой – бόльшую изгибаемость, что важно при сложной извитой конфигурации стеноза, а меньшие по размеру ячейки стента за наложения двух сеток обеспечивают меньшее пролабирование слизистой и за счет этого меньшую травматизацию.
Для определения протяженности стенозированного участка и надежного проведения направляющей струны использовали эндоскопы различного диаметра, включая педиатрические гастроскопы. Стентирование чаще всего выполняли под двойным - рентгенологическим и эндоскопическим – контролем. Стенты вводили через широкий инструментальный канал эндоскопа по проводнику, при этом использовали гибкие билиарные струны (46), реже (преимущественно при бластоматозной обструкции пищеводно-тонкокишечных анастомозов) – только под визуальным контролем по предварительно установленной струне, причем в этих случаях предпочитали использовать жесткий проводник (6). Следует отметить, что гастродуоденальное стентирование принципиально можно выполнить по жесткой струне, но тогда нужно использовать колоректальные стенты, которые имеют более длинное доставочное устройство, чем пищеводные (1 наблюдение). Однако технически это неоправданно сложно, поскольку стент в доставочном устройстве ложится на большую кривизну желудка, и адекватное позиционирование его требует хороших навыков и занимает довольно много времени, сопровождаясь большой лучевой нагрузкой. На наш взгляд, рентгенологический контроль при любой локализации поражения позволяет выполнять вмешательство более уверенно, так как зачастую на начальном этапе при стягивании оболочки стент может смещаться выше или ниже оптимального положения, что может быть легко исправлено на этой стадии.
Техническая погрешность в нашей серии наблюдений возникла при выполнении первого пилородуоденального стентирования по каналу эндоскопа: стент был установлен неадекватно и раскрылся в непораженной части двенадцатиперстной кишки, что потребовало повторного стентирования стент-в-стент с частичным перекрытием протезов (рис. 2). Интраоперационных осложнений не было.
Всем больным на следующие сутки после стентирования выполняли рентгенологический контроль положения и степени раскрытия стента. Во всех случаях протезы полностью расправились в течение 24‑48 часов, но в 1 (2,2%) случае мы отметили дислокацию полностью расправившегося непокрытого пилородуоденального стента в вертикальный отдел двенадцатиперстной кишки, что потребовало эндопротезирования стент-в-стент.
Кроме того, у 2 (4,3%) больных через 3 и 8 месяцев после установки мы наблюдали фрагментацию и перегиб непокрытых пилородуоденальных стентов (поздние осложнения). При эзофагогастроскопии практически на всем протяжении отмечалась поломка металлической конструкции, свободные отломки которой выстояли в просвет желудка, а на некоторых участках переплелись между собой. С учетом сохранения эвакуации жидкого содержимого и ожидаемой короткой продолжительности жизни больных в связи с прогрессированием основного заболевания какие-либо вмешательства было решено не предпринимать.
Повторные вмешательства в результате прогрессирования опухоли были выполнены у 2 больных. У 1 из них с инфильтративным раком тела желудка через 3 месяца после стентирования частичный некроз опухоли привел к восстановлению просвета, что позволило извлечь стент. Однако из-за быстрого продолженного роста опухоли в дистальном направлении через 3 недели возник стеноз пилоробульбарной зоны, что потребовало введения пилородуоденального стента. Еще у 1 больного через 2 месяца после стентирования зоны сдавления отводящей тонкой кишки извне непокрытым пилородуоденальным стентом на расстоянии 10 см от эзофагоэнтероанастомоза в результате прогрессирования метастатического процесса было диагностировано сдавление тонкой кишки выше стента и верхней части протеза с нарушением его проходимости. Было выполнено эндопротезирование стент-в-стент непокрытым колоректальным стентом с восстановлением адекватного перорального питания.
Наш опыт гастродуоденального и тонкокишечного стентирования при бластоматозных поражениях свидетельствует о достаточно высокой эффективности подобных вмешательств, как первичных, так и повторных, поскольку они позволяют восстановить проходимость желудочно-кишечного тракта на различных уровнях и улучшить качество жизни у инкурабельных больных. Однако в ряде случаев при большой протяженности опухолевого поражения, а также при канцероматозе стентирование может не привести к ожидаемым результатам, несмотря на адекватное восстановление просвета верхних отделов желудочно-кишечного тракта.

