Удаление лейомиомы нижнегрудного отдела пищевода с преимущественно экстраорганным характером роста методом эндоскопического тоннелирования
Федоров Е. Д., Плахов Р. В., Будзинский С. А., Галкова З. В., Селезнёв Д. Е., Полухина Е. А., Иванова Е. В., Горбачев Е. В.
НОЦ абдоминальной хирургии и эндоскопии: кафедра госпитальной хирургии № 2 с
НИЛ хирургической гастроэнтерологии и эндоскопии РНИМУ им. Н. И. Пирогова
(зав. - проф. С.Г. Шаповальянц); ГКБ №31 ДЗ г. Москвы ( гл. врач Р.А. Маслова)
г. Москва
До появления методики эндоскопического тоннелирования, неэпителиальные опухоли пищевода и кардии удалялись из просвета органа через гибкий эндоскоп лишь в тех случаях, когда по данным предварительного обследования они исходили из подслизистого слоя или собственной мышечной пластинки слизистой оболочки.
Происхождение, а соответственно и расположение неэпителиальных опухолей (НЭпО) пищевода в мышечном слое органа, а тем более в средостении, как правило, требовало торакоскопического доступа для их удаления. Это объяснялось не только высоким риском перфорации стенки органа, но и невозможностью надежной герметизации доступа после удаления опухоли с использованием внутрипросветных эндоскопических методов, сопровождающихся образованием значительного дефекта слизистой оболочки. Появление нового эндоскопического способа удаления опухолей данной локализации, исходящих из собственного мышечного слоя, открыло новые возможности в их лечении с использованием эндоскопа. Впервые данный способ применил в клинической практике H. Inoue с соавторами [1], обосновав его эффективность и безопасность у данной категории больных.
Суть методики эндоскопической резекции опухоли тоннельным доступом (ЭРОТД) заключается в удалении НЭпО путем создания продольного по отношению к оси органа тоннеля в подслизистом слое стенки пищевода через доступ, расположенный на 5 см проксимальнее ближайшей границы опухоли. При этом слизистая оболочка над удаленной опухолью остается сохранной, что обеспечивает герметизацию зоны резекции и значительно снижает риск потенциальных послеоперационных осложнений.
Цель сообщения.
Представить клинический случай, свидетельствующий о возможности применения методики ЭРОТД у пациентки с «трудной» для эндоскопического удаления неэпителиальной опухолью (лейомиомой) нижнегрудного отдела пищевода, исходящей из его мышечного слоя и преимущественно расположенной в заднем средостении, парааортально.
Материал и методы.
У пациентки Р., 54х лет, за год до поступления в нашу клинику, при амбулаторной ЭГДС была выявлена подслизистая опухоль нижнегрудного отдела пищевода, переходящая на кардиальный отдел желудка, шаровидной формы, диаметром 3 см. В течение этого периода пациентку периодически беспокоила лёгкая дисфагия (ощущение затруднения прохождения пищи), тошнота и нарастающая канцерофобия. В нашу клинику пациентка поступила в плановом порядке в начале июля 2013г. для проведения уточняющей диагностики и решения вопроса об оперативном лечении.
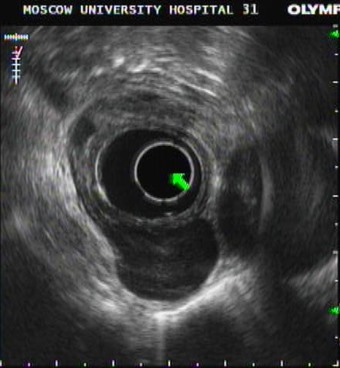
При ЭГДС на момент госпитализации было выявлено, что по задне-правой стенке нижнегрудного отдела пищевода с переходом на его абдоминальный отдел, периодически пролабируя в просвет органа, имеется округлая, умеренно подвижная подслизистая опухоль мягко-эластической консистенции диаметром 30 мм с неизмененной слизистой оболочкой над ней. Эндосонографическое исследование выявило, что подслизистая опухоль размерами 29х20 мм неправильной овальной дольчатой формы, состоящая из двух долей, с четкими неровными (по вутрипросветному контуру, за счет дольчатой структуры) границами, имеет гипоэхогенное строение несколько неоднородной структуры за счет наличия в центральной части эхогенных включений до 2-3мм, без акустических теней. Опухоль исходит из мышечного слоя задней стенки нижнегрудного отдела пищевода с распространением на его абдоминальный отдел, располагаясь на 1/3 внутрипросветно и на 2/3 экстраорганно (рис. 1).
Слизистый и подслизистый слои отчетливо прослеживались над образованием на всем протяжении. Было высказано предположение о наличии гастроинтестинальной стромальной опухоли с низким риском малигнизации или лейомиомы.
Учитывая клиническую картину, характер и локализацию образования, его связь с мышечным слоем, было принято решение об его эндоскопическом удалении методом эндоскопического тоннелирования в подслизистом слое.
Результаты.
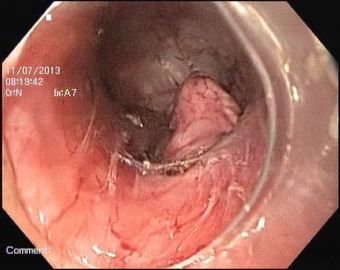
Удаление образования было выполнено 7 июля 2013г. в эндоскопической операционной под эндотрахеальным наркозом в положении больной на спине. В процессе выполнения ЭРОТД использовали видеоблок EVIS EXERA II, видеоэндоскоп GIF-Н180 с прозрачным колпачком на дистальном конце, CO2-инсуффлятор UCR - все Olympus (Япония). Для инфильтрации тканей подслизистого слоя использовали эндоскопическую инъекционную иглу диаметром 25G. После подслизистой инъекции 10 мл физиологического раствора с индигокармином был выполнен продольный разрез слизистой оболочки пищевода длиной до 2 см в 5 см проксимальнее опухоли. С использованием трёхгранного ножа KD-640L (Olympus) и электрохирургического блока ERBE VIO 300D был создан подслизистый тоннель, переходящий на кардию, позволивший визуализировать интраорганную часть опухоли до 21 мм в диаметре (рис. 2).
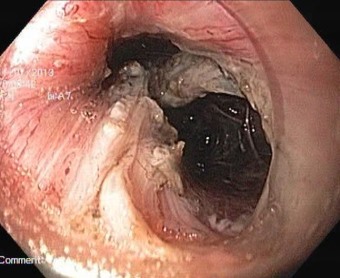
При выполнении дальнейшей диссекции, выделении опухоли и интраоперационной ревизии было выяснено, что опухоль действительно исходит из мышечного слоя, заключена в плотную белесоватую капусулу, интимно контактирует, но не прорастает окружающие ткани, имеет вытянутую дольчато-овоидную форму, истинные размеры 40х21мм, и большей своей частью располагается в заднем средостении. При помощи спрей-коагуляции, трёхгранного ножа и электроножа с изолированным наконечником опухоль была мобилизована в пределах здоровых тканей без повреждения капсулы, поэтапно полностью удалена по фрагментам с использованием полипэктомической петли и извлечена для последующего морфологического исследования (рис. 3).
полипэктомической петли через двойной
(подслизистый и мышечный) тоннель.
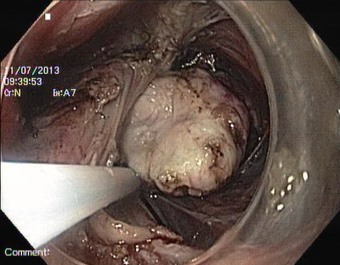
При этом значительную часть основания опухоли, расположенную в тканях заднего средостения, пришлось удалять через второй тоннель - «окно» около 2 см диаметром в мышечно-адвентициальном слое пищевода, ведущее в средостение (рис. 4).
Ненапряжённый карбоксиперитонеум, возникший в ходе операции, был ликвидирован параумбиликальной пункцией брюшной полости иглой Вереша. Перед завершением операции ложе удалённой опухоли в средостении, тоннель в мышечном и подслизистом слоях пищевода были санированы стерильным физиологическим раствором с антибиотиком. Затем «входной доступ» слизистой оболочки пищевода был герметично «ушит» путем наложения 8 эндоклипс HX-610-135L (Olympus, Япония).
Общее время вмешательства составило 220 минут. Интраоперационных осложнений не наблюдалось.
В течение первых суток послеоперационного периода пациентка воздерживалась от приёма любых жидкостей per os;
со вторых суток ей было разрешено пить, с третьих – употребление жидкой пищи. Непосредственно после вмешательства с целью профилактики осложнений пациентке был
назначен внутривенно болюсно ингибитор протоновой помпы в дозе 40 мг, который она получала дважды в день в течение последующих 2х суток. С 3х суток послеоперационного периода пациентка получала ингибитор в пероральной форме в дозе 20 мг 2 раза в день в течение 4х недель. Профилактическая антибактериальная терапия проводилась цефалоспоринами в дозе 2 мг 2 раза в день в течение 3х дней после операции.
Болевой синдром после операции практически отсутствовал; диспептических явлений также не наблюдалось.
При контрольном рентгенологическом исследовании через 6 часов после вмешательства в брюшной полости было обнаружено лишь небольшое количество свободного газа под куполами диафрагмы.
Послеоперационный период протекал без осложнений. Пациентка была выписана из стационара на 7 сутки в удовлетворительном состоянии.
При гистологическом исследовании удаленной опухоли были выявлены изменения, характерные для лейомиомы, что было подтверждено и данными иммуногистохимии - митозы отсутствуют, клетки опухоли интенсивно и равномерно экспрессируют актин гладких мышц и неравномерно - виментин, отсутствует экспрессия CD117, DOG-1, CD34 (при положительной реакции в эндотелии сосудов), Ki67 менее 1%.
При осмотре пациентки, выполненном через 5 месяцев после операции, её самочувствие хорошее, жалоб не предъявляет, симптомы дисфагии не беспокоят, полностью исчезла канцерофобия. При контрольной ЭГДС рецидива опухоли не выявлено, в зоне её расположения определяется нормальная слизистая оболочка без каких-либо изменений просвета, эластичности стенки или перистальтики пищевода; в области ушитого клипсами оперативного доступа на слизистой оболочке пищевода имеется мягко-тканный грануляционный рубец до 2 см длиной, не вызывающий деформации или сужения просвета органа. Следующее контрольное эндоскопическое исследование и осмотр пациентки запланированы на июль 2014 г.
Выводы.
Представленный клинический пример подтверждает эффективность, малую травматичность и безопасность данного вида вмешательства у больных с НЭпО пищевода и кардиального отдела желудка.
После тщательного изучения и освоения метод сможет использоваться при небольших опухолях, исходящих из мышечного слоя стенки органа, в том числе располагающихся в средостении, являясь альтернативной традиционных хирургических и лапаро/торакоскопических вмешательств.
Литература.
Inoue H., Ikeda H., Hosoya T., Onimaru M., Yoshida A., Eleftheriadis N.,
Maselli R., Kudo S. Submucosal endoscopic tumor resection for subepithelial tumors in the esophagus and cardia. // Endoscopy 2012; 44: 225–230.