Выбор способа ведения больных после эндоскопических резецирующих вмешательств на желудке и двенадцатиперстной кишке
Плахов Роман Валентинович – кандидат медицинских наук, доцент кафедры госпитальной хирургии №2 РНИМУ им. Н.И.Пирогова, Москва;
Бунцева Ольга Александровна – аспирант кафедры хирургии, анестезиологии и эндоскопии ФГОУ ДПО ИПК ФМБА, Москва;
Фёдоров Евгений Дмитриевич – доктор медицинских наук, профессор НИЛ хирургической гастроэнтерологии и эндоскопии РНИМУ им. Н.И.Пирогова, клинический руководитель отделения оперативной эндоскопии № 1 ГКБ №31, Москва;
Галкова Залина Викторовна - кандидат медицинских наук, старший научный сотрудник НИЛ хирургической гастроэнтерологии и эндоскопии РНИМУ им.Н.И. Пирогова, Москва;
Иванова Екатерина Викторовна - доктор медицинских наук, руководитель эндоскопического отделения МРЦ «Клиника +31», Москва;
Михалева Людмила Михайловна – доктор медицинских наук, профессор, руководитель лабораторией клинической морфологии ГУ НИИ морфологии человека РАМН, заведующая патологоанатомическим отделением ГКБ №31, Москва;
Горбачев Евгений Васильевич – врач-эндоскопист отделения оперативной эндоскопии №1 ГКБ № 31, Москва
НОЦ абдоминальной хирургии и эндоскопии: кафедра госпитальной хирургии № 2 с НИЛ хирургической гастроэнтерологии и эндоскопии РНИМУ им. Н. И. Пирогова (зав. - проф. Шаповальянц С.Г.); ГКБ №31 ДЗ г. Москвы (гл. врач Маслова Р.А.), МРЦ «Клиника+31» (гл. врач Чурадзе Б.Т. ), Москва
В последние годы в арсенал эндохирургов добавились современные методики эндоскопического удаления новообразований пищеварительного тракта. Речь идет о различных способах эндоскопической резекции слизистой оболочки (ЭРСО) и эндоскопической диссекции подслизистого слоя (ЭДПС), позволяющих радикально удалять новообразования, недоступные для традиционной полипэктомии. Многочисленные исследования и публикации доказали высокую эффективность и малую травматичность подобных операций, в том числе у больных с ранним раком [3, 4, 5]. В настоящее время целесообразность выполнения ЭРСО и ЭДПС у данной категории больных не вызывает сомнения, а темой для дальнейших дискуссий является лишь обсуждение показаний, ограничений и некоторых технических особенностей проведения вышеуказанных операций. Однако малоизученным остается вопрос о послеоперационном ведении данных пациентов, включая характер и объем антисекреторной терапии, необходимость и сроки выполнения контрольных эндоскопических исследований, а также целесообразность превентивного эндоскопического гемостаза (ЭГ). Единичные публикации на данную тему не позволяют выработать единую позицию, что требует дальнейшего изучения этого вопроса [1,2].
Цель сообщения.
Представить промежуточные результаты проспективного рандомизированного исследования по выбору способа ведения больных после эндоскопических резецирующих вмешательств на желудке и двенадцатиперстной кишке.
Материал и методы.
В продолжающееся проспективное рандомизированное исследование включено 25 пациентов, перенесших в нашей клинике эндоскопические резецирующие вмешательства по поводу новообразований желудка или двенадцатиперстной кишки (ДПК) за период XII.2012- XII.2013.
Среди пациентов было 7 мужчин и 18 женщин в возрасте от 38 до 83 лет (средний возраст 62,6±11,4 лет). Все больные методом блоковой стратификационной рандомизации были распределены на 2 группы (табл.1). Группа ИПП предусматривал выполнение контрольной ЭГДС на 2 сутки после вмешательства без рутинного выполнения превентивного ЭГ, который по условиям исследования осуществлялся вынужденно, лишь при наличии крупного (более 1,5 мм) обнажённого видимого сосуда в дне послеоперационного дефекта (высокий риск развития геморрагии), а также в случае продолжающегося или недавно перенесенного кровотечения.
| Таблица 1. Характеристика пациентов и удаленных новообразований | ||||
| Характеристики \ Группы | Группа ИПП | Группа ИПП+ЭГ | Р | Всего |
| Всего пациентов, в т.ч. муж. жен. возраст средний возраст |
11 2 9 48-76 г.г. 62,7±10,3 лет |
14 5 9 38-83 г.г. 62,5±12,7 лет |
р=0,89 | 25 7 18 38-83 г.г. 62,6±11,4 лет |
| Локализация: - желудок - ДПК |
10 1 |
13 1 |
23 2 |
|
| Диаметр опухоли средний диаметр |
7-70 мм 21,5±15,6 мм |
7-40 мм 16,1±9,7 мм |
р=0,51 | 7-70 мм 18,4±12,7 мм |
| Опухоль - эпителиальная - неэпителиальная - нейроэндокринная |
10 1 - |
11 1 2 |
21 2 2 |
|
У пациентов группы ИПП+ЭГ во время аналогичной контрольной ЭГДС осуществлялся превентивный ЭГ во всех случаях обнаружения в дне послеоперационного дефекта сосудистых стигм, за исключением мелких плоских окрашенных пятен. ЭГ проводился путем наложения гемостатических клипс на все видимые тромбированные сосуды в дне послеоперационного дефекта. Антисекреторная терапия в обеих группах больных была идентичной и осуществлялась по следующей схеме: первые три дня после оперативного вмешательства – препарат контролок 80 мг в сутки внутривенно, затем в течение последующего месяца (в том числе амбулаторно) – 80 мг препарата в сутки перорально. В случае развития послеоперационного кровотечения парентеральная дозировка препарата контролок увеличивалась до 160 мг/сутки.
В группу ИПП к моменту написания данной работы вошло 11 (44%) пациентов: 10 после резекции эпителиальной опухоли и 1 - неэпителиальной (НЭпО); в группу ИПП+ЭГ – 14 (56%) пациентов: 11 после резекции эпителиальной опухоли, 1 – НЭпО и 2 - нейроэндокринной опухоли (НЭО). Пациенты обеих групп статистически не различались по возрасту: средний возраст составил соответственно 62,7±10,3 и 62,5±12,7 лет (р=0,89). У 23 пациентов новообразование располагалось в желудке, у 2 – в ДПК. Размер удаленных новообразований составил 7-70 мм (средний размер – 18,4±12,7 мм): группа ИПП - 21,5±15,6 мм; группа ИПП+ЭГ 16,1±9,7 мм; р=0,51 (табл. 1). У 1 пациента группы ИПП и 2 больных группы ИПП+ЭГ эпителиальная опухоль носила рецидивный характер.
Результаты.
Под местной анестезией вмешательства были выполнены у 7 пациентов, под внутривенной анестезией - у 11 и эндотрахеальным наркозом - у 7 пациентов (табл. 2). В группе ИПП было выполнено 7 ЭРСО, 3 ЭДПС и 1 резекция НЭпО. В группе ИПП+ЭГ было произведено 8 ЭРСО, 3 ЭДПС, 1 резекция НЭпО и 2 удаления НЭО. Средняя продолжительность вмешательств в группах составила 59,1±37,8 и 73,6±49,9 минут, соответственно (р=0,53) (табл. 2).
| Таблица 2. Характеристика перенесенных оперативных вмешательств | ||||
Характеристики \ Группы |
Группа ИПП |
Группа ИПП+ЭГ |
Р |
Всего |
Обезболивание: м/а в/в наркоз ЭТН |
1 7 3 |
6 4 4 |
|
7 11 7 |
Длительность операции: среднее время |
25-130 мин. 59,1±37,8 мин. |
20-180 мин. 73,6±49,9 мин. |
р=0,53 |
20-180 мин. 67,2±44,7 мин. |
Вид операции - ЭРСО: - ЭДПС - удаление НЭпО - удаление НЭО |
7 3 1 - |
8 3 1 2 |
|
15 6 2 2 |
Всего операций |
11 |
14 |
|
25 |
В финале оперативного вмешательства у 9 (81,8%) больных группы ИПП и 8 (57,1%) –группы ИПП+ЭГ был выполнен дополнительный ЭГ (табл. 3). С этой целью наиболее часто использовалась методика клипирования (4 больных), а также электрокоагуляция при помощи эндограспера (6 больных). При этом стремились добиться полного укрытия/ликвидации сосудистых структур в дне и в краях послеоперационного дефекта. Как следует из табл. 3, средний диаметр дефекта слизистой оболочки в конце оперативного вмешательства составил 22,3±16,2 мм (группа ИПП – 23,2±18,4 мм, группа ИПП+ЭГ – 21,5±15,1 мм; р=0,74).
| Таблица 3. Завершающий этап оперативных вмешательств | ||||
| Характеристики\Группы | Группа ИПП | Группа ИПП+ЭГ | Р | Всего |
| Дополнительный гемостаз: - проводился - не проводился |
9 (81,8%) 2 (18,2%) |
8 (57,1%) 6 (42,9%) |
17 (68%) 8 (32%) |
|
| Диаметр п/о дефекта: средний диаметр |
10-75 мм 23,2±18,4 мм |
10-45 мм 21,5±15,1 мм |
р=0,74 | 10-75 мм 22,3±16,2 мм |
Во время проведения контрольной ЭГДС на 2 сутки после операции получены следующие результаты (табл. 4). Отсутствие каких-либо сосудистых стигм в дне послеоперационного дефекта, покрытого чистым фибрином, зафиксировано у 12 (48%) больных. Мелкие окрашенные пятна, не потребовавшие каких-либо гемостатических мероприятий, имелись у 6 (24%) пациентов. У 1 (9,1%) пациента группы ИПП и 5 (35,7%) больных группы ИПП+ЭГ, т.е. в общей сложности у 6 (24%) больных, в дне послеоперационного дефекта имелись единичные тромбированные сосуды до 1,5 мм диаметром; в группе 2 по условиям рандомизации у данных пациентов осуществлен ЭГ методикой эндоклипирования. Лишь у 1 (4%) больной группы ИПП на вторые сутки после удаления гигантской стелящейся аденомы луковицы ДПК в послеоперационном дефекте, занимающем 2/3 полуокружности, визуализирован крупный (более 1,5 мм) обнажённый сосуд (рис. 1), что потребовало изменить условия рандомизации и выполнить превентивный ЭГ методом эндоклипирования (рис.2).

ЭРСО в луковице ДПК

Признаков продолжающегося или недавно перенесенного кровотечения при контрольном обследовании мы не наблюдали.
| Таблица 4. Результаты контрольной ЭГДС на 2 сутки после резекции | |||
| Характеристики\Группы | Группа ИПП | Группа ИПП+ЭГ | Всего n=25 |
| чистый фибрин мелкие сосудистые пятна тромбированные сосуды до 1,5мм обнажённые сосуды более 1,5мм продолжающееся кровотечение |
5 (45,5%) 4 (36,4%) 1 (9,1%) 1 (9,1%) (ЭГ-1) - |
7 (50%) 2 (14,3%) 5 (35,7%) (ЭГ-5)* - - |
12 (48%) 6 (24%) 6 (24%) (ЭГ-5)* 1 (4%) (ЭГ-1) - |
| Всего (число пациентов) | 11(100%) | 14(100%) | 25 (100%) |
У 1 (4%) пациентки М., 60 лет из группы ИПП+ЭГ к исходу 2 суток после ЭДПС (рис.3), выполненной по поводу изъязвленной тубулярно-ворсинчатой аденомы желудка с умеренной дисплазией, возникло желудочнокишечное кровотечение лёгкой степени тяжести, продолжающееся на момент повторной экстренной ЭГДС и остановленное прицельным эндоклипированием. Интересен факт, что данное осложнение развилось через несколько часов после контрольной ЭГДС с профилактическим клипированием всех имевшихся тромбированных сосудов (рис.4), что, тем не менее, не гарантировало отсутствие геморрагии.

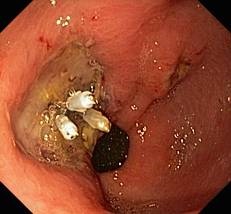
Следует отметить, что больная страдала злокачественным течением гипертонической болезни, и по нашему мнению, именно резкий неконтролируемый подъём артериального давления явился основной причиной развития кровотечения в послеоперационном периоде. После успешного выполнения ЭГ пациентке была усилена гипотензивная терапия, а также удвоена дозировка антисекреторного препарата, что привело к выздоровлению.
Суммируя данные продолжающегося исследования можно отметить, что:
- у 72% (18/25) пациентов, перенесших эндоскопические резецирующие вмешательства на желудке и ДПК, при контрольной ЭГДС не имелось значимых стигм потенциального кровотечения (чистый фибрин в дне язвенного дефекта или плоские мелкие пятна);
- у 24% (6/25) больных в дне послеоперационного дефекта имелись мелкие (до 1,5мм диаметром) тромбированные сосуды, причем отсутствие превентивного гемостаза у подобного больного из группы 1 не привело к развитию кровотечения, но число пациентов в этой подгруппе пока мало и несопоставимо;
- лишь у 1(4%) пациента в дне операционной раны на 2 сутки после вмешательства имелся крупный (более 1,5мм диаметром) тромбированный сосуд, что послужило абсолютным показанием к проведению профилактического эндогемостаза;
- послеоперационное кровотечение, несмотря на отсутствие значимых сосудистых стигм в дне дефекта при контрольной ЭГДС, развилось у 1 (4%) больной и, по нашему мнению, было связано с некоррегированной артериальной гипертензией.
Заключение.
У подавляющего числа (96%) пациентов, перенесших эндоскопические резецирующие вмешательства по поводу новообразований желудка и ДПК, на 2 сутки после оперативного вмешательства на фоне приема ингибитора протонной помпы в объеме 80 мг в сутки во время контрольной ЭГДС отсутствовали стигмы вероятного кровотечения в виде крупных (более 1,5мм) тромбированных сосудов. Желудочно-кишечное кровотечение на 2 сутки после ЭДПС возникло лишь у 1 (4%) пациентки на фоне резкого повышения артериального давления в раннем послеоперационном периоде. Важным условием профилактики кровотечения в послеоперационном периоде является адекватная антисекреторная терапия, а также коррекция сопутствующей патологии.
Литература.
1. Goto O, Fujishiro M, Kodashima S, et al. A second-look endoscopy after endoscopic submucosal dissection for gastric epithelial neoplasm may be unnecessary: a retrospective analysis of postendoscopic submucosal dissection bleeding. // Gastrointest. Endosc 2010;71:241-248;
2. Hyung Hun Kim, Seun Ja Park, Moo In Park, and Won Moon Clinical Impact of Second-Look Endoscopy after Endoscopic Submucosal Dissection of Gastric Neoplasms // Gut and Liver, Vol. 6, No. 3, July 2012, pp. 316-320;
3. Kakushima N. and Fujishiro M. Endoscopic submucosal dissection for gastrointestinal neoplasms. // World J Gastroenterol. 2008 May 21; 14(19): 2962–2967;
4. Larghi A., Waxman I. State of the art on endoscopic mucosal resection and endoscopic submucosal dissection. // Gastrointest Endosc Clin N Am. – 2007. – V.17(3). – P.441-69;
5. Ono H. et al. Endoscopic mucosal resection for treatment of early gastric cancer // Gut. 2001; V.48: P.225–229.

